背景
多数肿瘤患者的病情进展过程中,往往表现为不可逆的食欲下降、体重丢失、营养状况恶化,直至最后患者死亡,这就是肿瘤恶液质(ca-chexia)。恶液质常伴发于慢性疾病,包括:恶性肿瘤、慢性阻塞性肺病、慢性心衰、慢性肾衰、肝功能不全、艾滋病、风湿性关节炎等。其中,恶性肿瘤的恶液质发病率高,有报道,进展期肿瘤约60%~80%出现恶液质,实际上,恶液质在肿瘤生长的早期阶段即可出现。恶液质并不是指传统思想里的骨瘦如柴、病入膏肓,及时发现、愈早干预,治疗效果愈好。
关于恶液质的定义比较公认的是Fearon K教授2011年在肿瘤恶液质国际共识中提出的定义[1]:以持续性骨骼肌丢失(伴有或不伴有脂肪组织丢失)为特征,不能被常规营养支持完全缓解,逐步导致功能损伤的多因素综合征。该定义指出了恶液质的三个最重要的特点:骨骼肌持续丢失、常规营养支持不能完全缓解、功能损伤。其中骨骼肌丢失是恶液质的核心表现,蛋白(特别是肌肉蛋白)过度分解是其重要的病理生理改变。骨骼肌丢失的外在表现主要是体重丢失及乏力。Tis-dale MJ认为[2],当患者的体重丢失大于稳定体重的30%时,则死亡开始出现,而且不可避免。
恶液质可以在早期发现,并且是可以干预的,而恶液质发展到晚期,则抗癌治疗及营养支持均很难有效果,因此,对恶液质进行分期很重要。《欧洲肿瘤恶液质临床指南》中将肿瘤恶液质分为三期:恶液质前期、恶液质期、恶液质难治期。
恶液质前期:表现为厌食/代谢改变,如果有体重丢失则不超过5%。进展风险取决于肿瘤类型和分期、系统性炎症的存在、低摄入量、对抗癌治疗的无反应。
恶液质期:6个月内体重丢失大5%(排除单纯饥饿);或者BMI小于18.5kg/m²(这里参照中国营养不良标准,笔者注),同时体重丢失大于2%;或者四肢骨骼肌指数符合肌肉减少症诊断标准(男性<7.26kg/m²;女性<5.45kg/ m²),同时体重丢失大于2%;常有摄食减少或系统性的炎症。
恶液质难治期:肿瘤持续进展,对治疗无反应,活跃的分解代谢,体重持续丢失无法纠正。WHO体力评分3或4分,生存期预计不足3个月。
需要说明的是,并非所有的肿瘤患者都经历这三个阶段。肌肉丢失是恶液质最核心的特征。由于精确测量体成分较难开展,因此临床将体重丢失作为恶液质最主要的临床表现。
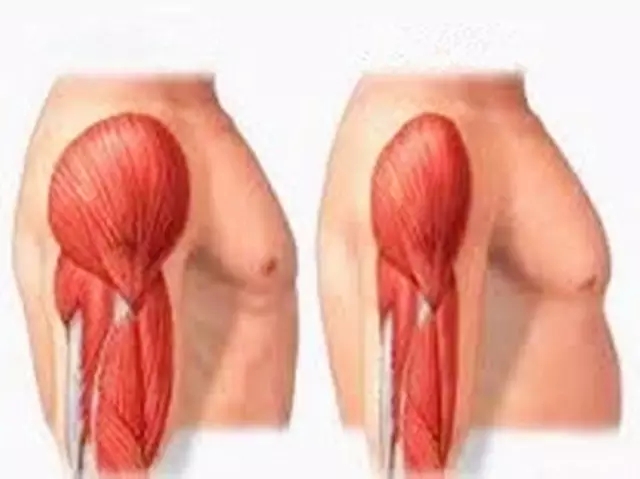
恶液质不仅要分期,还需要进行分级。恶液质的分级即恶液质的严重性,包括体重丢失的速度、能量储备、蛋白质消耗的速度,以及初始储备。例如:同样是BMI值减少5kg/m²,初始BMI为22kg/m²患者的恶液质较BMI为35kg/m²的要严重。另外,同样的BMI和丢失程度,相比于肌肉群正常的患者,伴有肌肉丢失出现的患者风险要大。
因此,对恶液质的早期发现和干预是防止其恶化的最关键手段。由于药物干预在治疗厌食及代谢紊乱中的作用非常有限,目前研究已经聚焦于应用营养治疗恶液质,包括肠内营养和肠外营养的方法。在恶液质前期及恶液质期,营养支持不仅可以增加患者能量及各种营养素的摄入,改善患者营养状况,还可以调节肿瘤患者的异常代谢,有益于抗肿瘤治疗。从临床结局来看,营养支持能提高患者生活质量,甚至延长生存期。而在难治性恶液质期,尽管营养治疗可能无法完全逆转其体重丢失及代谢异常,且要考虑营养支持带来的风险和负担可能超过其潜在的益处,但部分营养的摄入仍可能改善患者生活质量,并给患者及家属带来安慰,且对难治性恶液质的识别有助于患者得到临终关怀团队的帮助。恶液质营养治疗的最终目标是逆转体重丢失和肌肉丢失;对难治性恶液质主要是减轻恶液质相关症状、提高整体生活质量。
在对肿瘤恶液质进行营养治疗前,需要进行肿瘤恶液质的诊断及评估。诊断恶液质后要进一步评估如下三个方面:体重丢失(包括肌肉量及力量)、摄入量(包括厌食情况)以及炎症状态。只有评估这些表型后,才能进行相应的针对性治疗。其中,食物摄入量的调查很关键,也往往被忽略:摄入量调查一方面预测能量及营养素的摄入不足对营养状况及恶液质发展状况的影响;另一方面摄入量本身是恶液质状态的反映,如因厌食、疼痛、抑郁等引起食物摄入减少;第三,食物摄入量的改变是营养治疗及抗肿瘤治疗效果的展现及效果评价指标之一,营养干预有效可能改善患者炎症状态、可能减少厌食、增加食欲等;因此,了解患者食物摄入情况很重要。在营养咨询时,对患者摄入量的调查是其主要组成部分[1]。

我们推荐PG-SGA作为恶液质患者的营养评估[3],推荐厌食恶液质问卷作为厌食症/恶液质治疗的功能性评估(the Functional Assessment of An-orexia-Cachexia Therapy, FAACT)。
证据
尽管营养治疗预防或逆转肿瘤恶液质患者的体重丢失,提高生活质量,延长生存期的证据不多,但仍有一些临床研究证据支持营养咨询及营养支持的有效性。
研究表明,由专业营养师(配合临床医生)开展的对患者的密切随访(包括对营养状况的关注、营养咨询、饮食指导)可能提高患者生活质量,甚至延长生存期。通过营养咨询和饮食指导从而增加能量和蛋白质的摄入已被证明是有效的,能改善肿瘤患者的营养状况[4]。

Ravasco P等新近一项RCT研究在较小样本量人群中发现,长期、密切、个体化的营养咨询和营养支持不仅可以改善肿瘤患者的营养不良、减少肿瘤治疗并发症、提高生活质量,并且显著延长了患者的生存时间[5]。
Isenring EA等[6]的发现,60名接受放疗的头颈部肿瘤及消化道肿瘤患者,经12周密切的一对一的营养咨询和营养支持,与仅仅给予营养宣教的对照组相比,干预组可预防化疗引起的患者体重丢失,使PG-SGA评分下降(提示营养状态改善),体现生活质量的KPS评分增加,体力活动不下降。
Temel JS等[7]的研究发现,早期积极的营养咨询、指导和ONS可延长非小细胞肺癌患者生存期,提升患者生活质量,改善患者抑郁及焦虑症状。肿瘤治疗+营养治疗组的中位生存时间为11.6个月,而仅仅肿瘤治疗组的生存时间为8.9个月。12周干预过程中,肿瘤治疗+营养治疗组抑郁症状发生低于肿瘤治疗组(16% vs.38%), 焦虑症状发生也低于肿瘤治疗组(25% vs.30%)。
Bauer JD等[8]研究发现,接受化疗的肿瘤恶液质患者接受每周一次的营养咨询,并建议摄入含有EPA的ONS,持续8周。8例患者有7例完成了该研究。结果发现,总蛋白摄入(平均每天改变量为0.3g/kg,范围0.1~0.8g)、总能量摄入(平均每天改变量为36kJ/kg, 范围2~82kJ/kg)、总纤维摄入(平均每天改变量6.3g/d,范围3.4~20.1)、营养状况(患者PG-SGA评分平均改变量为9,范围-5~17)、卡氏评分(平均改变量10,范围0~30)、生活质量评分(平均改变量16.7,范围0~33.3)、体重(平均变量为2.3kg、范围-2.7~4.5kg)、瘦体组织(平均改变量4.4kg,范围-4.4~4.7kg)均有明显改善。结果表明,尽管差异并没有统计学意义,但营养咨询、饮食指导对患者的营养状态改善有益,且营养状态的改变与生活质量、体能状态、瘦体组织有明显的相关性。
美国肿瘤学会知情选择指导中指出对于大多数进展期肿瘤患者需要调整饮食模式以适应营养需求,可以有效控制症状及不良反应。对于患者不能摄入足够固体食物满足营养需求时,建议补充营养剂。
肠内营养指从消化道给予特殊医学用途食品,途径包括口服及管饲,后者有鼻胃管、鼻肠管、PEG、PEJ等。以下三种情况建议给予肠内营养从而提高或维持营养状况:摄入不足导致的体重丢失;预计7天不能进食;超过10天进食量不足每日消耗量60%。另外,对于无法治愈的患者,只要患者同意,并且未进入濒死阶段,建议给予肠内营养以减轻症状。但是当存在系统性炎症时,单纯通过肠内营养恢复体细胞群非常难。对于进展期肿瘤患者,单纯营养支持不能带来生存获益,但当联合抗感染治疗及针对代谢异常治疗时,可能会有阳性结果。
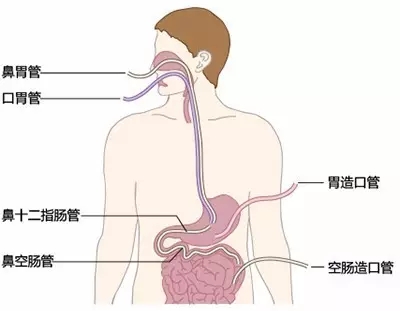
Orrevall Y等[9]对21个居家姑息照护中心的621名患者进行了调查,其中55%的患者有营养支持(41%的患者用ONS,14%的患者用管饲肠内营养、肠外营养或二者联合),结果发现,低BMI及体重严重丢失的患者营养支持率高,而且在生存时间短的患者中更多地被应用。
Strasser F表示[10]:对于晚期患者的支持需要考虑伦理问题,包括自主性(患者自主决定是否接受医疗),益处(是否能给患者带来大的益处), 兼顾公平(所需要的资源对于所获得的益处是值得的)。即使首选肠内营养,也应注意不良反应,包括误吸、肺炎、瘘、腹泻、梗阻、肠管堵塞、喂养管移位、呕吐、吸收不良、电解质紊乱、高血糖和感染等。
肠内营养对部分选择性患者是有效的。对于难治性恶液质阶段,在不增加进食相关不适的情况下,可给予肠内营养。
有营养不良的肿瘤患者,在进行化疗的同时,如果无法实施肠内营养,建议给予TPN[11]或补充性肠外营养(supplemental parenter-al nutrition,SPN)。
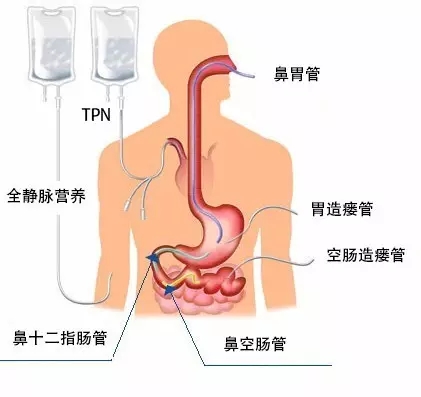
Lundholm K等[12]的研究表明,口服饮食加上家庭肠外营养(home parenteral nutrition,HPN),可改善肿瘤恶液质患者生存时间,使能量平衡,体脂肪增加,身体活动能力增加。
Shang E等[13]对给予姑息化疗/放疗的肿瘤患者提供ONS,并加上SPN(需要量的30%),结果显示可改善患者48周时的生存率、身体组成和生活质量。
Hasenberg T等的研究[14]表明,对于姑息治疗的进展期结直肠癌患者早期给予SPN,可提高患者生活质量,改善化疗相关不良反应,并改善患者人体成分。
但对于难治性恶液质,或预期生存期不足2月的肿瘤患者,Bosaeus I[15]认为PN不仅不会带来生存获益,反而常导致并发症,尤其会增加感染并发症。ESPEN指南推荐PN用于预计生存期超过2个月、肠功能衰竭不能进食的患者。
美国肿瘤学会指出对于患者知情选择PN,要注重个体化及对可能的并发症风险要充分认识。ASPEN及美国营养学会均提示PN的应用要有选择性及警示性。
针对进展期肿瘤患者,PN在极少数情况下需要应用,大部分情况不推荐使用,特别是对于难治性恶液质,PN所带来的不良反应往往大于益处。
PUFA炎症反应在恶液质的发生发展中起作用,尤其在体重丢失肿瘤患者中炎症进程非常强烈,炎症状态所介导的高分解代谢大量消耗了患者的营养摄入。具有抗炎效应的ω-3 PUFA, 包括DHA和EPA在恶液质中的作用得到研究。Fearon KC等[16] 在一项多中心、双盲、安慰剂对照的临床研究中纳入了518例体重减少的晚期胃肠癌、肺癌患者,随机分为实验组和安慰剂组:实验组每天服用2g(n=175)或4g(n=171)EPA,安慰剂组(n=171)服用安慰剂,平均体重丢失基线值为18%(三组基线值可比),观察4周和8周后发现,EPA实验组的生存率、体重和其他营养有关参数上并没有显著改善。但EPA对主要结局指标—体重有影响,尽管差异不显著(P=0.066)。与安慰剂组比较,2g EPA组平均体重增加1.2kg(95% CI=0-2.3),4g EPA组平均体重增加0.3kg(95% CI=0.9-1.5)。

Fearon KC等[17]开展了一项国际的、多中心的、随机对照研究,观察富含ω-3 PUFA和抗氧化剂的口服营养补充剂对胰腺癌患者体重丢失和瘦体组织丢失的影响。其中,95例患者为实验组,105例患者为对照组。实验组在常规饮食外摄入的ω-3 PUFA量相当于每天6g鱼油,且维生素C和维生素E的量分别超过日常推荐量的4倍和8倍。对照组采用常规饮食。结果表明,瘦体组织重量的改变与血浆EPA含量间存在线性关系,这表明ω-3 PUFA摄入增加,机体蛋白质沉积也增加。此外,当体重改变与饮食蛋白质摄入量有关时,仅仅与那些额外摄入了ω-3 PUFA的患者表现出正相关关系,即蛋白质与ω-3 PUFA协同发挥促进机体蛋白质合成的效应。
EPA具有抗炎,降低PIF产生,阻止骨骼肌分解的效果。ASPEN指南推荐使用,但在ESPAN指南中没有被明确推荐,EPA单独给予的效果仍有意见分歧,在现阶段作为综合治疗的一环是被认同的。
BCAA抑制蛋白分解,同时促进蛋白合成,具有改善食欲缺乏的效果。Hunter DC等报道[18]9例腹腔腺癌患者分别先后给予普通TPN(含BCAA 19%)或富含BCAA的TPN(BCAA 50%),结果显示酪氨酸氧化下降(提示蛋白质利用改善)、蛋白质及白蛋白合成增加,说明BCAA对肿瘤恶液质有明显的正效应。
Gramingnano G等[19]对12名进展期肿瘤患者每天给予肉碱6g,连续4周,发现肉碱可改善患者食欲、瘦体组织和疲倦。Cruciani RA等在27例肉碱缺乏的进展期肿瘤患者中的研究发现,添加肉碱可改善肿瘤患者的疲倦、睡眠和抑郁症状[20]。
尽管营养支持能增加能量的摄入到一定程度并且可持续一定的时间,但是它并不能解决根本的分解代谢问题。以营养支持来削弱肿瘤诱导的分解反应的作用是有限的。而药物治疗可减少厌食,削弱全身性炎症,减少骨骼肌肉分解代谢或刺激肌肉蛋白合成代谢,从而可能会减缓消耗的进程[16]。因此,预防及改善肿瘤恶液质可能需要多学科联合的方式和更早开始的干预。营养治疗从ONS开始,其在大多数案例中优于PN。患者一旦出现严重的消耗,除了营养治疗,其他任何的干预既不实际也不道德。
改善所有肿瘤患者恶液质状态不太可能,但是我们的目的是稳定恶液质,防止或延缓其进一步发展。目前来看,对于所有的患者没有哪种单一或联合治疗是成功的。然而,抵消高分解代谢、抑制饮食摄入减少的策略已被证明对肿瘤患者生存率、功能和生活质量是重要的,并且应该在以后的干预研究中进一步探讨。
推荐意见

